BIOQUÍMICA DE LOS ALIMENTOS
martes, 26 de abril de 2016
REFERENCIAS BIBLIOGRÁFICAS
REFERENCIAS BIBLIOGRÁFICAS
Considine D.M.; Considine G.D. Foods and food production encyclopedia. Van Nostrand Reinhold
Company, New York (1983).
Sierra Majem, Lluíz; Arantceta Bartrina, Javier. (1995). Nutrición y Salud Pública: métodos, bases
científicas y aplicaciones. Barcelona: Masson.
Walker B. Gums and stabilisers in food formulations. In: Phillips G.O.; Wedlock D.J.; Williams P.A.
(Eds.), Gums and stabilisers for the food industry 2, Elsevier Applied Science and Publishers,
Barking, England (1984).
Badui Dergal, Salvador. (1981). Química de los Alimentos. México: Longman de México Editores S.A. de C.V.
HIDROFILIA Y EFECTO CRIOPROTECTOR
FUNCIÓN DE LOS CRIOPROTECTORES
Estos compuestos muy hidrófilos (en general polialcoholes) tienen la capacidad de penetrar fácilmente en la célula por simple difusión (ósmosis), sus moléculas retrasan la formación de cristales de hielo por el descenso del punto de congelación. Por otra parte, limitan los efectos de la solución, eliminando una parte del agua intracelular por elevación de la presión osmótica extracelular. Los
hidratos de carbono desempeñan una función protectora de las membranas celulares.
La sacarosa confiere un efecto protector adicional, ya que este crioprotector, no permeable, causa una deshidratación, con lo cual se reduce la probabilidad de formación de hielo intracelular.
HIDROFILIA
Una molécula hidrofílica es aquella que puede enlazarse temporalmente con el agua a través de un enlace hidrógeno. Esto es favorable termodinámicamente, y hace solubles a las moléculas no sólo en agua sino también en otros disolventes polares. Debido a esto también se las conoce como moléculas polares. Algunas sustancias hidrofílicas no se disuelven, y este tipo de mezcla se denomina entonces coloide. Las membranas celulares tienen partes hidrofílicas e hidrofóbicas. Las moléculas hidrofóbicas son moléculas sin grupos cargados y sin átomos capaces de formar puentes de hidrógeno
Se trata principalmente de moléculas con cadenas hidrocarbonadas (HC) alifáticas o aromáticas
Las moléculas hidrofóbicas fuerzan a las moléculas de agua a formar una estructura en forma de jaula alrededor de la molécula. La atracción del agua por parte de los carbohidratos es una de sus propiedades más importantes y está condicionada por la presencia de grupos OH en la
estructura. La velocidad de unión de los carbohidratos con el agua está dada en muchos casos por su estructura, así la D-fructosa es mucho más higroscópica que la D-glucosa, por su parte la sacarosa y la maltosa a una humedad de 100% absorben la misma cantidad de agua, mientras que la lactosa absorbe mucho menos.
Estos compuestos muy hidrófilos (en general polialcoholes) tienen la capacidad de penetrar fácilmente en la célula por simple difusión (ósmosis), sus moléculas retrasan la formación de cristales de hielo por el descenso del punto de congelación. Por otra parte, limitan los efectos de la solución, eliminando una parte del agua intracelular por elevación de la presión osmótica extracelular. Los
hidratos de carbono desempeñan una función protectora de las membranas celulares.
La sacarosa confiere un efecto protector adicional, ya que este crioprotector, no permeable, causa una deshidratación, con lo cual se reduce la probabilidad de formación de hielo intracelular.
HIDROFILIA
Una molécula hidrofílica es aquella que puede enlazarse temporalmente con el agua a través de un enlace hidrógeno. Esto es favorable termodinámicamente, y hace solubles a las moléculas no sólo en agua sino también en otros disolventes polares. Debido a esto también se las conoce como moléculas polares. Algunas sustancias hidrofílicas no se disuelven, y este tipo de mezcla se denomina entonces coloide. Las membranas celulares tienen partes hidrofílicas e hidrofóbicas. Las moléculas hidrofóbicas son moléculas sin grupos cargados y sin átomos capaces de formar puentes de hidrógeno
Se trata principalmente de moléculas con cadenas hidrocarbonadas (HC) alifáticas o aromáticas
Las moléculas hidrofóbicas fuerzan a las moléculas de agua a formar una estructura en forma de jaula alrededor de la molécula. La atracción del agua por parte de los carbohidratos es una de sus propiedades más importantes y está condicionada por la presencia de grupos OH en la
estructura. La velocidad de unión de los carbohidratos con el agua está dada en muchos casos por su estructura, así la D-fructosa es mucho más higroscópica que la D-glucosa, por su parte la sacarosa y la maltosa a una humedad de 100% absorben la misma cantidad de agua, mientras que la lactosa absorbe mucho menos.
ESPESANTES Y ESTABILIZANTES
En la actualidad se ha extendido el uso de polisacáridos de alto peso molecular que tienen la capacidad de actuar como espesantes y gelificantes, y que además presentan propiedades funcionales como las de emulsificación, estabilización, etc. Las gomas son estos productos obtenidos de la exudación de algunas plantas y árboles; sin embargolos podemos encontrar de manera natural, semisintéticas y sintéticas, estas últimas no aprobadas para el consumo humano.
Las propiedades de las gomas dependen de dos factores:
-Intrínsecos: propios de la molécula como el peso molecular, los grados de ionización y de ramificación, etc.
-Extrínsecos: propios del sistema, tales como el pH, la fuerza iónica, temperatura, concentración de los otros componentes, etc.
El usto de gomas, aunque no puede ser sustituida con otro polisacárido para la fijación de aromas en alimentos, en la industria es muy utilizada para helados, confitería, jugos de fruta, cerveza, vinos, mayonesas, quesos, mermeladas, aderezos, embutidos, productos dietéticos, etc.
GOMA GUAR alfa-D-galactopiranosil
-Soluble en agua fría
-Tixotrópicas: al batirse, se enblanquecen
GOMA GARROFIN O ALGARROBO
-Muy utilizada pra postres, helados, debido a su capacidad para dar textura
GOMA ARÁBIGA O GOMA ACACIA
-Heteropolisacárido muy ramificado
-Tiene alta solubilidad en agua y baja viscosidad
-Heroglicano (que posee varias moléculas) en helados y sorbetes
TRAGACANTO
-Estable al calor
-Utilizada para salsas, aderezos por sucapacidad para dar claridad y brillo
CARRAGENANO
-Sinérgico: incrementa la viscosidad y firmeza en geles
ALGINATO
-Proporciona textura y cuerpo a los helados, salsas y aderezos
XANTANO
-Mejora la palatabilidad en bebidas y aromas para estos mismos
-Estabiliza la turbidez
HIDRATOS DE CARBONO
HIDRATOS DE CARBONO
Compuestos con estructura de
polihidroxialdehído o de polihidroxiacetona; fuente más abundante y barata de
alimentos de la naturaleza. Contienen Carbono, Hidrógeno y Oxígeno. Cualquier
HC contiene en su estructura el grupo sacárido o glucosídico. El sacárido
proviene de un aldehído (aldosa) o una cetona(cetosa).
Clasificación:
-Simples: son de fácil absorción,
y contienen menos de 10 moléculas de azúcar unidas.
-Compuestos: constituidos a
partir de moléculas de 50 o más moléculas de azúcar.
Estructura
Para que el grupo sacárido en un
monosacárido pueda ser un HC, debe estar constituido por al menos tres carbonos,
que sería el más pequeño.
En la estructura de los HC,
cuando el grupo sacárido está situado en el primer carbono será una Aldosa;
pero al estar en otro lugar, este será una Cetosa.
MONOSACÁRIDOS
Los monosacáridos más comunes
(tetrosas, pentosas, hexosas) derivan del D-gliceraldehído con la adición de
CHOH a la cadena básica de carbonos. El átomo número 2 del gliceraldehído puede
existir como isómeros D y L; en los primeros el hidroxilo del carbono
asimétrico más alejado del aldehído se encuentra a la derecha del plano lineal
de la molécula. y en los de la serie L dicho hidroxilo de referencia se ubica a
la ixquierda del plano central.
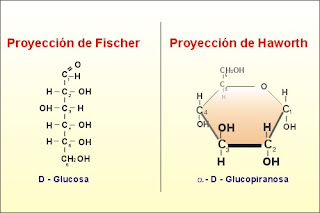
Las representaciones químicas
pueden hacerse con las proyecciones de Fischer y de Haworth o con la fórmula
conformacional. En la primera, los carbonos están en una cadena lineal abierta
y se enumeran a partir del aldehído, pero en el caso de las cetosas se hace por
el átomo de carbono más cercano a la cetona.
En la esctructura de Haworth encontramos a los monosacáridos en dos tipos: la piranosa hexagonal y furanosa pentagonal, que tienen los mismos carbonos pero su acomodo es distinto:
La representación en forma de silla o tridimensional es utilizada para dos o más monosacáridos; es la más utilizada.
Los epímeros son compuestos
isómeros pero difieren únicamente en la posición de un hidroxilo (OH). Y
decimos que un carbohidrato es dextrógiro (giro hacia la derecha) cuando el
penúltimo OH se encuentra de el lado derecho, y levógiro (giro hacia la
izquierda) en el lado opuesto.
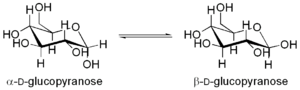
Se define anómero como el isómero de un monosacárido de más de
5 átomos de carbono que ha desarrollado una unión hemiacetálica,
lo que le permite tomar una estructura cíclica y determinar dos posiciones diferentes para el grupo hidroxilo: α, o β, según sea su
orientación bajo el plano, o sobre el plano, en una proyección de Haworth.
FUNCIÓN DE LOS MONOSACÁRIDOS EN LOS ALIMENTOS
Poder Edulcorante
No son azúcares pero poseen la propiedad de dar sabor dulce a los alimentos, por eso es que tiene el poder edulcorante, lo cual sólo se presenta en hidratos de carbono de cadenas cortas.
Conservación
Los solutos de peso molecular bajo reducen la presión de vapor de agua y paralelamente aumentan la presión osmótica; lo que nos indica que los monosacáridos pueden ser utilizados para el control microbiológico de diversos hongos, levaduras y bacterias.
Cristalización
Los azúcares tienen la capacidad de presentar el fenómeno del polimorfismo que consiste en que un mismo compuesto puede cristalizar en diversas formas.
Hidratación
Facilidad que tienen los OH de los azúcares de establecer puentes de hidrógeno con el agua. La hidratación se aprovecha para el control de la actividad acuosa de los alimentos.
POLISACÁRIDOS
Polímero constituido por más de 10 monosacáridos, con ramificaciones como las amilosas o sin ellas como las pectinas. Los polisacáridos representan del 70 al 80% de nuestro aporte de calorías consumidas. Entre ellos encontramos el almidón, glucógeno, celulosa (fibra), hemicelulosa (fibra), quitina (fibra), glucoproteínas, gomas, glucoaminoglucanos. Y dentro de estos, los únicos que realmente los humanos podemos digerir son el almidón, el glucógeno y algunas dextrinas, y los podemos encontrar en granos, semillas y plantas. Cabe destacar sin embargo, que ningún polisacárido posee un sabor dulce estando crudo; algunos de ellos al ser expuestos al calor se tornan dulces por el efecto de la hidrólisis de las moléculas.
ALMIDÓN
Principal polisacárido de reserva de la mayoría de los vegetales y principal fuente calórica de los seres humanos. Es la mezcla de amilosa y amilopectina, ambos formados por unidades de glucosa.
GLUCÓGENO
Polisacárido de reserva energética animal, formado por cadenas ramificadas de glucosa en forma de amilopectinas. Es almacenado principalmente en hígado y músculo, y es utilizado para la glucólisis.
Una molécula de glucógeno tiene más de 120,000 moléculas de alfa-glucosa formada por enlaces 1-4 glucosídicos.
CELULOSA
Este polisacárido es la fibra y el más abundante en toda la naturaleza. Lo encontramos en las paredes de las células vegetales. Este es el que nos ayuda a aumentar el número de deposiciones intestinales facilitando la digestión. Lo encontramos por ejemplo en las cascarillas del trigo, el salvado de avena, cebada, etc. El ser humano no posee la enzima para desdoblarla. Está compuesta por moléculas de glucosa, es rígido, insoluble en agua y sus en laces son beta 1-4 glucosídicos.
Generalmente la encontraremos acompañada de celobiosa para formar hemicelulosa.
QUITINA
Es el principal componente estructural del exoesqueleto de invertebrados como crustáceos, insectos y arácnidos; así como el segundo polímero natural más abundante después de la celulosa. También está presente en algas y hongos. Es un homopolisacárido formado por unidades repetidas de N-acetil-D-glucosamina, unidos por enlasces beta 1-4.
Lo encontramos en tres formas: Alfa-quitina, Beta-quitina, Delta-quitina.
GLUCOPROTEINAS
Polímeros compuestos por una proteína que contiene hidratos de carbono ya sean simples o compuestos. Su función principal es el reconocimiento celular como el tipo de sangre en nuestro cuerpo. Las encontramos en los eritrocitos (glóbulos rojos), y está conformado por dos aldosas: Beta-D-glucosa y Beta-D-xilosa.
AMINOGLUCANOS O GLUCOAMINOGLUCANOS
Son polímeros de glucosa que contienen N-acetilglucosamina o N-acetilgalactosamina. Se diferencía de la quitina gracias a sus azúcares sulfatados. Funciona como regulador térmico, y no es absorbido por el intestino. Inhibe la síntesis protéica y podría presentar toxicidad de mayor o menor grado.
sábado, 23 de abril de 2016
REACCIONES DE OSCURECIMIENTO NO ENZIMÁTICO
Existe en productos que tienen que ver con hidratos de carbono, y otra que nada tiene que ver con ellos.
El pardeamiento oxidativo se realiza en presencia de oxígeno, polifenol-oxidasa y sustrato fenólico. Por ejemplo: cuando añadimos limón al aguacate, evitamos la acción de la enzima anteriormente mencionada.
PARDEAMIENTO NO OXIDATIVO O NO ENZIMÁTICO
Para que un alimento cambie su color, se pueden dar reacciones oxidativas o no oxidativas. Las primeras suceden por la presencia de las tres sustancias mencionadas (02, Polifenol-oxidasa y sustrato fenólico), pudiendo ser llevadas a cabo no sólo en hidratos de carbono, si no en muchos otros, pues no tiene que ver con el hecho de ser azúcares o no. Las segundas provocan un cambio en la coloración del alimento pero no debido al oxígeno. Estas reacciones no oxidativas son: la de Maillard, oxidación del ácido ascórbico, peroxidación de lípidos, caramielización.
Existen tres tipos de caramelización:
-Ácido rápido: llevada a cabo en refrescos, generalmente de cola.
-Color malteado: como en la cerveza.
-Caramelo de confitería: azúcar cristalizada que al enfriarse, se torna muy duro.
CARAMELIZACIÓN
Reacción de oscurecimiento también llamada pirólisis que ocurre cuando los azúcares se calientan por encima de su punto de fusión; se efectúa tanto en pH ácidos como alcalinos y se acelera con la adición de ácidos carboxílicos y de algunas sales. Se presenta en alimentos que son tratados térmicamente de manera drástica como la leche condensada y azucarada, derivados de panificación, frituras, dulces a base de leche como cajeta, natillas, etc.
REACCIÓN DE MAILLARD
Conjunto de transformaciones que traen consigo la producción de melanoidinas coloreadas que van desde amarillo claro hasta café oscuro, o incluso negro. Se requiere de un azúcar reductor (cetosa o aldosa) y un grupo amino libre proveniente de un aminoácido o una proteína.
HIDRÓLISIS DE HIDRATOS DE CARBONO
Es la transformación de moléculas de gran tamaño a productos más sencillos y fácilmente degradables. En el caso de los polisacáridos, estos son tratados con agua y ácidos para hacer las moléculas más pequeñas.
Hidro= Agua
Lysis= ruptura
Para que la
hidrolisis de lleve a cabo, se requieren los siguientes factores:
· -Ph
acido
· -Temperatura
arriba de 150°c
· -Oligosacáridos
· -Conformación
anomerica alfa
MECANISMO
Existen dos etapas que ocurren al mismo tiempo:
-Descomposición: separación de moléculas de agua y HC
-Intercambio: reacomodo entre esos componentes
TIPOS
·
Conversión
acida 45% glucosa o equivalentes de dextrosa
·
Conversión
acido-enzimática 60%
·
Conversión
enzimática-enzimática 80%
(Glucosa dos veces la
enzima)
(Fructosa agregación de
enzima alfa y después enzima beta)
jueves, 21 de abril de 2016
REACCIONES DE DESHIDRATACIÓN Y DEGRADACIÓN TÉRMICA
·
Se
puede realizar en alimentos ácidos y bases
·
Se
elimina la configuración beta generalmente en pentosas y hexosas.
Las aldosas, pentosas y hexosas sufren con mayor frecuencia estas reacciones
DESVENTAJAS
-Estas reacciones deben ser realizadas con su debida precaución debido a la Beta-eliminación que podría suceder al momento de la deshidratación, ocasionando agentes cancerígenos.
-Puede haber fragmentación de cadenas al ser tratados termicamente.
-Cuando no hay rompimiento de cadenas, hay cambio de :
a) anomerización: de aldosa pasa a ser cetosa y visceversa sin perder el azúcar, únicamente cambiando su conformación
b) Isomerización: de conformación alfa a beta y visceversa sin abandonar su constitución de azúcar.
c) Deshidratación: la reacción más drástica, inter e intramolecular, aunque continua siendo un azúcar.
Suscribirse a:
Entradas (Atom)